熒光共定位分析是對細胞中兩種帶有熒光標記的蛋白、細胞器或者藥物、納米材料等之間的空間相互位置關系進行分析,以確定它們是否定位于同一區域或存在相關性,在細胞生物學、藥理學、醫學、植物學等研究領域具有廣泛的應用。
最直觀最簡單的共定位分析就是直接看不同顏色的熒光之間是否重疊,比如蛋白A標有綠色熒光,蛋白B標有紅色熒光,如果蛋白A和B共定位則綠色紅色疊加顯示為黃色(圖1)。只是這種方式無法提供準確的定量結果,已無法滿足科研工作者越來越高的要求。所以我們需要可以提供量化結果的更專業的共定位分析。

LAS X軟件作為Leica顯微成像系統的搭載平臺,不僅能夠提供完美的成像質量,而且整合了眾多高級應用并具有強大的后期數據處理分析功能,包括FRAP功能、FRET功能,圖像2D、3D測量與自動分析功能,當然也有共定位分析功能Colocalization analysis,且操作非常簡單,下面我們就來看看徠卡的共定位分析怎么做吧!
1 進入Quantify

2 在Tools中選擇Colocalization
共定位分析是對兩個熒光通道之間進行分析,所以對于通道數多于兩個通道的數據,需要先確定分析哪兩個,把暫不分析的通道點灰,即可得到共定位結果及散點圖。
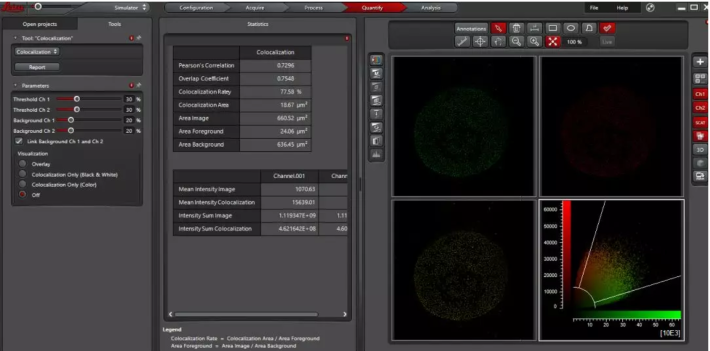
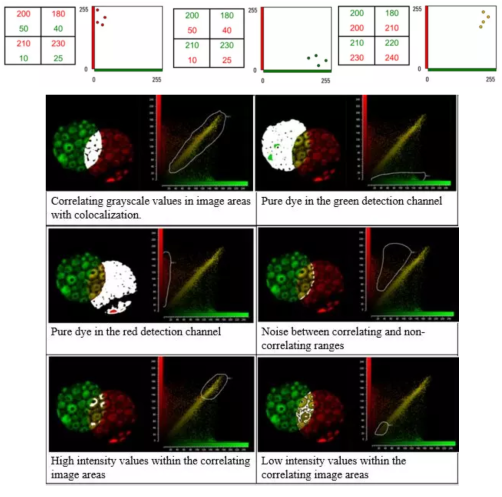
散點圖Cytofluorogram:兩熒光通道中熒光信號的空間分布和熒光強度的二維散點圖,如x軸為綠色信號,y軸為紅色信號,根據每個像素點中紅綠兩種熒光信號灰度值得到其在圖中的坐標,展現分子共定位和相互作用程度。
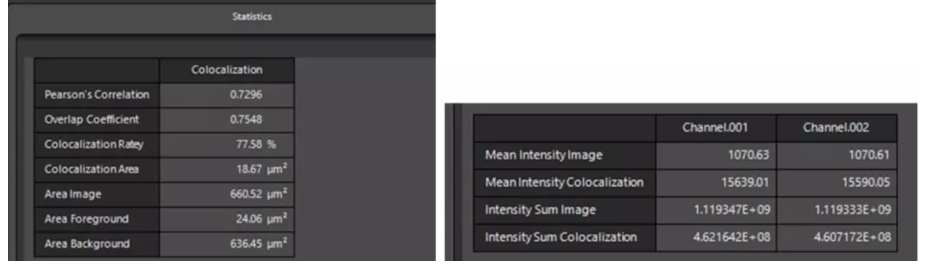
3 Statistics里面即顯示共定位分析結果:Pearson's Correlation,Overlap Coefficient,Colocalization Rate等。既可以對整張圖進行分析,也可以使用區域選擇工具圈出感興趣區域ROI進行分析。

4 Parameters 為了得到更準確的結果,可以進行相關的參數設置。
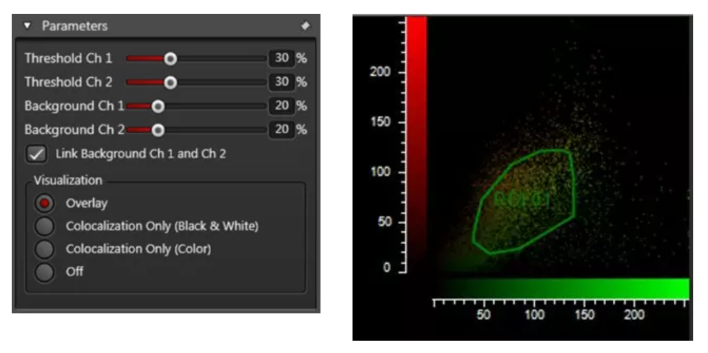
ThresholdCh 1& ThresholdCh 2:灰度值低于設定閾值的像素不納入共定位分析范圍
Background Ch 1 & Background Ch 2:灰度值低于設定閾值的像素作為背景不納入共定位分析范圍。
也可以使用區域選擇工具在散點圖中圈出共定位分析的灰度值范圍。
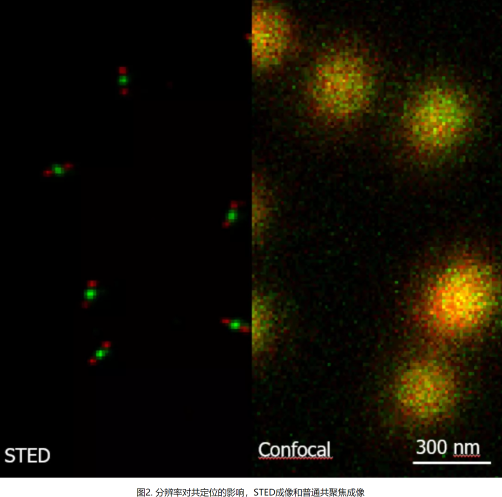
共定位結果的精準度與圖像的分辨率密切相關。但由于衍射極限的存在,常規共聚焦光學分辨率只有200nm左右,如果是觀察大于200nm的結構當然輕松,也很容易就能準確判斷其共定位程度,但細胞內的亞細胞器、蛋白結構等尺寸往往更小,我們如果需求更精準的結果就需要選擇與之匹配的超高分辨率成像技術:如達到120nm的高分辨率LIGHTNING技術,達到30~50nm的超高分辨率STED技術(圖2)等。隨著分辨率的提高我們可以看到的結構越來越精細,得到的共定位結果當然越來越準確。所以在進行共定位實驗時我們可以盡量選擇更高分辨率的成像方式。
此外在樣品準備和采圖時:
1) 串色會嚴重干擾到共定位結果的準確性,所以實驗時可盡量選擇串色較少的染料組合以避免串色帶來的干擾;如果選擇的染料串色,采圖時也可以優化調節檢測范圍以排除串色干擾,當然也可以使用序列掃描的方式。
2) 采圖時盡量選擇高數值孔徑的物鏡以獲取最優分辨率,同時注意采樣頻率需要滿足Nyquist采樣定理(可通過Optimize xy-Format功能來調節format實現),從而得到與最優分辨率匹配的pixel size,以避免采樣頻率不足導致的信息丟失,以及采樣頻率過高可能引起的光漂白。
3) 采圖時確保各熒光通道不過曝,盡量獲取信噪比好的圖像。優異的原始數據是后期定量分析和去卷積處理的最佳保障。
4) 采圖后可進行去卷積處理(如Huygens或者HyVolution中的deconvolution)以獲取信噪比、分辨率更好的數據,得到更準確的共定位分析結果。
5) 共定位分析有多種分析算法,如Pearson's Correlation,Overlap Coefficient,Colocalization Rate等,每種算法都有各自的特點和最佳適用情況,所以我們需要根據具體情況來選擇,或者采用結合多種算法結果來分析【1】【2】【3】。
最后,祝大家可以輕松愉快地做好共定位分析實驗啦。